- Главная
- Полезные статьи, памятки и видео о заболеваниях сердца
- Дженерики и оригинальные препараты
Ваше мнение будет учтено
Каждый пациент периодически сталкивается с ситуацией, когда нужно сделать выбор среди препаратов, содержащих одно и то же действующее вещество, но имеющих разных производителей и часто разную стоимость. О чем важно помнить при выборе лекарственного препарата среди «себе подобных»? Давайте обсудим этот вопрос и поговорим об оригинальных препаратах и дженериках.
— лекарственный препарат с новым действующим веществом, который первым зарегистрирован в России или в иностранных государствах на основании результатов доклинических и клинических исследований, подтверждающих его качество, эффективность и безопасность1.
В свою очередь воспроизведенный лекарственный препарат (в обиходе его также называют дженерик) определяется, как лекарственный препарат, содержащий такой же качественный и количественный состав действующих веществ и такую же лекарственную форму как у оригинального препарата, а также, подтвержденную исследованиями биоэквивалентность или терапевтическую эквивалентность референтному (оригинальному) лекарственному препарату1.
Термин «воспроизведенный лекарственный препарат» имеет и другие названия: аналог, генерик, копия.
После создания и регистрации оригинальной молекулы законодательства многих стран предоставляют первому производителю патентную защиту. Россия — не исключение. Патент дает производителю эксклюзивные права (временную монополию) на производство и продажу препарата с конкретной молекулой в течение ограниченного времени. Государственная регистрация первого лекарственного средства с новым действующим веществом подтверждает, что препарат оригинален и его безопасность и эффективность проверены и подтверждены необходимыми исследованиями1.
В сети интернет можно встретить много информации о дешевых аналогах оригинальных лекарственных средств с отметкой, что это то же самое, но дешевле. Давайте попробуем разобраться, чем же могут различаться оригинальные лекарственные препараты и дженерики и почему не всегда возможно поставить знак равенства между ними.
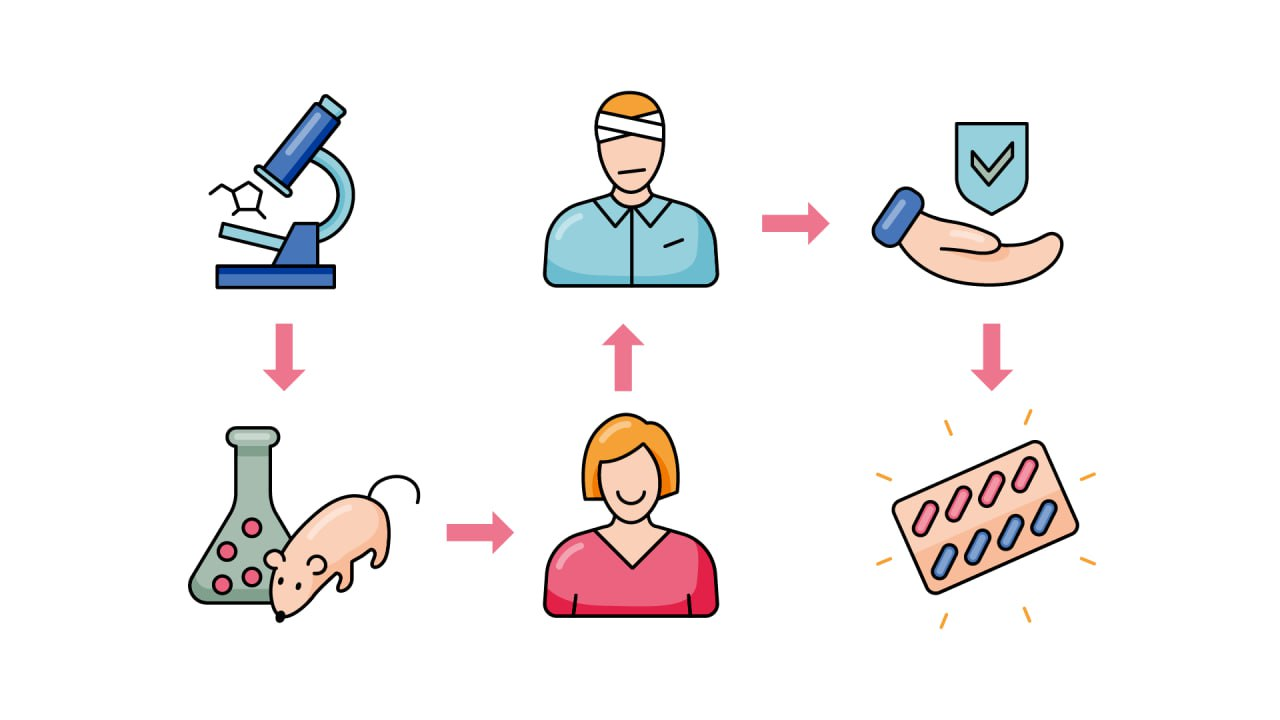
Чтобы появиться на аптечных полках, впервые синтезированные препараты проходят дорогостоящие исследования, доказывающие их безопасность и эффективность. Производитель вкладывает деньги, силы, время и труд учёных в:
Доклинические исследования — химические, физические, биологические, фармакологические и токсикологические. На этом этапе научными методами изучается и оценивается эффективность и безопасность лекарственных средств. Проводятся на клеточных культурах и лабораторных животных.
Клинические исследования. Это исследования уже с участием человека. Они выявляют или подтверждают клинические и/или фармакологические эффекты исследуемых препаратов в сравнении с плацебо (веществами, не имеющими явных лечебных свойств, которые используются в качестве имитации лечебного препарата), оценивают терапевтический эффект, выясняют нежелательные реакции, изучают особенности всасывания, распределения, метаболизма и выведения лекарства из организма.
Поэтому порой на создание одного нового лекарства и его тщательную проверку уходит 12–20 лет и очень много средств2.
Чтобы дженерик вышел на рынок в России, ему будет достаточно одного из исследований — биоэквивалентности или терапевтической эквивалентности (чаще выбирают первое). А вместо отчёта о результатах собственных доклинических исследований фармацевтическая компания может предоставить обзор научных работ о результатах доклинических исследований действующего вещества1.
Биоэквивалентность дженерика и оригинального препарата означает отсутствие значимых различий по скорости и степени всасывания при приеме в одинаковых дозах и лекарственных формах на основании определения их концентрации в организме3.
Также нужно помнить, что производитель дженерика имеет право использовать те вспомогательные вещества, которые считает нужными и подходящими. По этой причине дженерик и эталонное средство могут иметь разный цвет, вкус, запах и иные органолептические характеристики5.
Прежде всего стоимость оригинального препарата включает затраты на его разработку и исследования. Лишь несколько молекул из тысяч доходят до следующего этапа — экспериментов с животными, после которых остается одна молекула, которая уже проходит в следующий этап — клинические испытания — сначала с участием здоровых добровольцев, а затем и пациентов.
В каждом клиническом исследовании ученые оценивают и анализируют определенные клинические показатели, которые отражают изменение состояния пациента при применении лекарства. Часто исследования длятся несколько лет, в них участвуют тысячи пациентов из многих стран мира.
Только после завершения клинических испытаний, доказавших эффективность и безопасность лекарственного препарата, он оказывается доступным для потребителя. Весь процесс создания и тщательного изучения нового лекарства длительный, занимает 12–20 лет и сопряжен с большими расходами, которые в дальнейшем учитываются при формировании цены.
Самый простой вариант — уточните у лечащего врача. Врач сможет ответить на все ваши вопросы, объяснить выбор назначенной терапии.
Второй путь — обратитесь в аптеку и уточните информацию у провизора или фармацевта.
Также информацию о категории лекарства можно получить на сайте Единого реестра зарегистрированных лекарственных средств Евразийского экономического союза6. Указав в поле поиска название лекарственного средства, вы выбираете нужный препарат и в графе «Характеристики лекарственного препарата» указана информация — «вид»: воспроизведенный (дженерик) или оригинальный.
1. Федеральный закон от 12.04.2010 N 61-ФЗ "Об обращении лекарственных средств" Документ загружен с сайта КонсультантПлюс www.consultant.ru Дата обращения 07.11.2024
2. Официальный сайт «Детралекс» https://detralex.ru/articles/originalnye-preparaty-i-dzheneriki/ Дата обращения к ресурсу 22.01.2025
3. Решение Совета Евразийской экономической комиссии от 03.11.2016 N 85 (редакция от 12.04.2024) "Об утверждении Правил проведения исследований биоэквивалентности лекарственных препаратов в рамках Евразийского экономического союза"
4. Верлан Н.В., Ковальская Г.А., Жукова Д.Я., Кочкина Е.О., Солодухина О.А. Взаимозаменяемость лекарств с позиций фармацевтического соответствия и клинической эффективности и безопасности. Качественная клиническая практика. 2016;(3):66-72.
5. Generic medicines. Health Navigator NZ https://healthify.nz/medicines-a-z/g/generic-medicines/ Дата обращения к ресурсу 08.11.2024
6. Портал общих информационных ресурсов и открытых данных ЕАЭС, сайт Единого реестра зарегистрированных лекарственных средств ЕАЭС https://portal.eaeunion.org/sites/commonprocesses/ru-ru/Pages/DrugRegistrationDetails.aspx Дата обращения к ресурсу 08.11.2024